Linkul direct catre Petitie
Citiți și cele mai căutate articole de pe Fluierul:
ieri 22:16
_ În interiorul industriei dezinformarii
ieri 21:16
_ PAOK s-a oprit în sferturile competiţiei
ieri 15:56
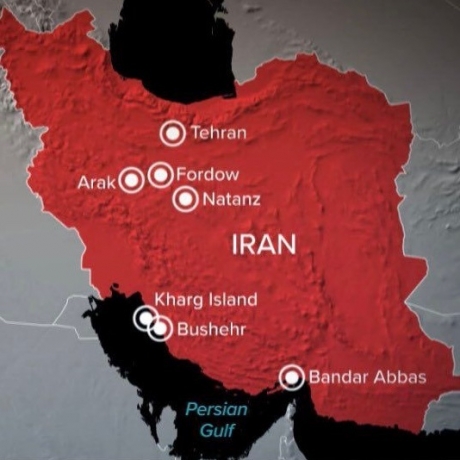
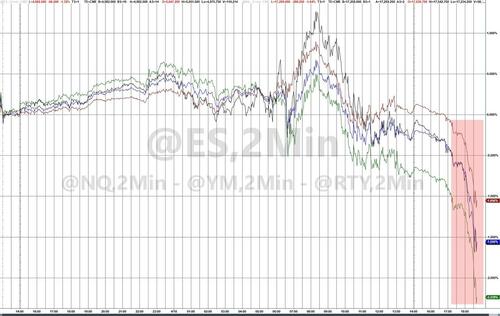
_ „Rezerva Federală este în mod clar prinsă”
ieri 12:56
_ Lancea din spatele AI
ieri 11:55
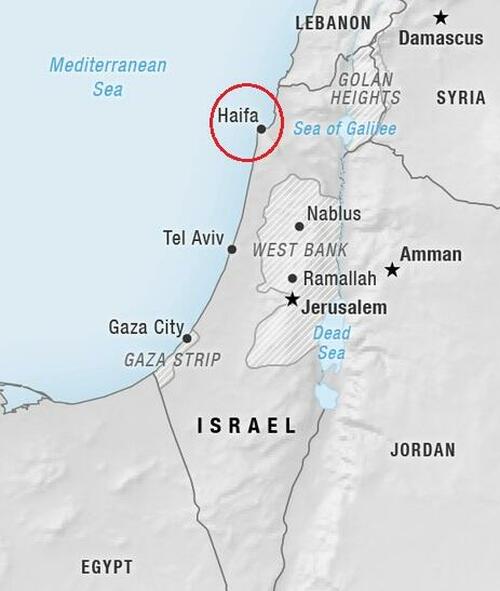
_ Un nou caz de spionaj zguduie Germania
ieri 10:35
_ Curs valutar, 18 aprilie
ieri 09:17
_ De Rossi va continua ca antrenor al Romei






















































Comentarii:
Adauga Comentariu